


血管内分泌系统功能紊乱在再生缺陷和器官受损后的纤维化中起着重要作用,但其具体机制仍不清楚。本文首先在人类和小鼠数据库中发现,硫化氢(H2S)-AMP活化蛋白激酶(AMPK)代谢途径是纤维化过程中应激的传感器,会上调内皮细胞中血管分泌因子纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,PAI-1)的表达,参与肺纤维化的进程。其次证实了在人纤维化的肺内皮细胞中,AMPK的活性受到抑制,其与肺顺应性的降低正相关。在小鼠肺纤维化模型中同样发现,AMPK的失活会加速肺纤维化的进行,用二甲双胍激活AMPK后缓解了肺纤维化。进一步的研究表明,在纤维化肺组织内皮细胞中AMPK失活会激活YAP和PAI-1的表达,出现肺纤维化的特征,使用Tiplaxtinin(PAI-1抑制剂)处理后可以缓解该过程。最后的研究揭示了H2S 的缺乏是肺纤维化中内皮细胞AMPK失活和YAP-PAI-1信号通路激活的原因。补充H2S可以以一种内皮AMPK依赖的方式逆转肺纤维化。上述研究为更好的理解纤维化中血管内分泌系统失调的机制提供了新的见解。
Result 1:AMPK 失活参与了小鼠和人的肺纤维化
作者首先分析了小鼠纤维化肺内皮细胞的RNA-seq数据,发现纤维化肺内皮细胞中的AMPK信号受到抑制,分离纯化小鼠正常和纤维化肺组织的内皮细胞后进行免疫印迹检测。结果表明,AMPK的磷酸化水平降低。在人类对照和纤维化肺的转录组数据中同样观察到,AMPK 信号在纤维化肺组织中表达下调,Spearman 相关分析显示AMPK 信号与纤维化基因,如COL1A1,COL3A1,ACTA2等的表达呈负相关。此外,肺纤维化患者的外周血单个核细胞中的AMPK (PRKAA1)表达水平也降低,PRKAA1的表达与肺功能参数(DLCO和FVC)正相关。以上数据表明在人和小鼠纤维化肺中AMPK的活性受到系统性(内皮细胞,肺组织和外周血单个核细胞)的抑制,AMPK失活与肺纤维化相关。
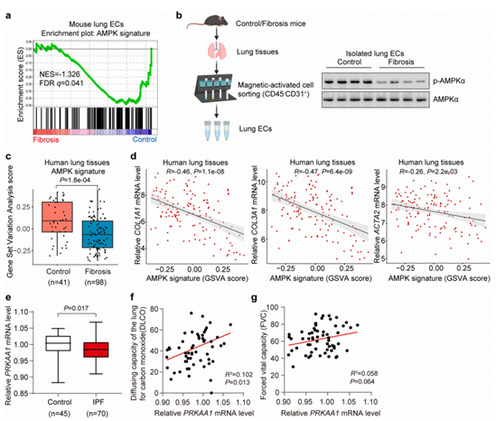
Result 2:内皮细胞中AMPK失活有利于肺纤维化的进程
进一步检测了内皮细胞中AMPK失活与肺纤维化的关系。研究发现,人类和小鼠中AMPK的催化α亚单位有α1和α2两个亚型,分别由Prkaa1和Prkaa2编码。在肺内皮细胞中Prkaa1的表达丰度远高于Prkaa2。因此,作者构建了野生型(Prkaa1WT)和Prkaa1敲除(Prkaa1△EC)的小鼠博来霉素肺纤维化模型。结果表明,与对照组相比,Prkaa1△EC组促进了肺纤维进程,表现为纤维化肺组织中的细胞外基质(ECM)的沉积增加,纤维化相关基因 mRNA(Col1a1,Col3a1,CTGF,Fn1)和蛋白质(Collagen I,αSMA,CTGF)表达升高和羟脯氨酸的积累增强。此外,用AMPK 激活剂二甲双胍处理,可激活纤维化肺内皮细胞中的AMPK,减缓博来霉素诱导的小鼠肺纤维化。这些数据表明,内皮细胞AMPK失活有助于肺纤维化发展。而AMPK 激动剂二甲双胍可激活内皮 AMPK,逆转肺纤维化。

接下来,研究揭示了内皮细胞AMPK调节肺纤维化的机制。敲除人脐静脉内皮细胞(HUVECs)中的PRKAA1后bulk RNA-seq分析发现,纤维化相关HALLMARK基因的富集增加。有意思的是在五个关键HALLMARK基因集的交集鉴定了两个常见基因F3和SERPINE1,只有SERPINE1显著上调。众多周知,SERPINE1是丝氨酸蛋白酶抑制剂超家族的一员,编码纤维蛋白溶酶原激活物抑制剂-1(PAI-1),在组织纤维化中发挥重要作用。因此作者推测内皮细胞中AMPK可能通过抗纤溶因子PAI-1调节肺纤维化。结果显示,敲低PRKAA1后,HUVECs细胞中SERPINE1 mRNA表达上调。体内实验同样表明,与各自的对照组相比,人,小鼠和Prkaa1△EC纤维化肺内皮细胞中SERPINE1 mRNA的表达量显著增加。这些数据表明PAI-1是内皮细胞AMPK中的关键下游因子。
之前的研究指出,Hippo/YAP 通路参与组织损伤、纤维化和修复,在代谢应激条件下AMPK可以抑制 Hippo/YAP 途径。作者进一步探讨了Hippo通路是否参与了内皮细胞中AMPK对PAI-1的抑制作用。结果表明,在内皮细胞中敲除Prkaa1,Hippo效应物YAP被激活。ChIP-seq分析发现,YAP及其伴侣TAZ和TEAD1可以与SERPINE1启动子结合。并且shYAP和verteporfin(YAP的抑制剂)处理后,内皮细胞中SERPINE1的表达量降低。综上所述,AMPK失活会造成纤维化肺内皮细胞中YAP的活化,导致血管分泌因子SERPINE1 (PAI-1)的转录增加。

作者又研究了PAI-1在人和小鼠肺纤维化中的作用。Spearman 相关分析表明,SERPINE1与 COL1A1、COL3A1、CCN2、FN1等纤维化基因的表达水平呈正相关。此外,TPX(PAI-1抑制剂)治疗减少了纤维化肺组织的重塑,胶原沉积和纤维化基因(Col1a1,Col3a1,Ctgf,Fn1)的表达。表明PAI-1可以促进肺纤维化。

Result 5:内皮细胞中H2S-AMPK轴通过Hippo/ YAP途径调节PAI-1的表达
在内皮细胞代谢应激过程中,内源性硫酸(H2S)可以通过调节ATP/AMP的比率来靶向线粒体呼吸链激活AMPK,是重要的氧化剂清除剂。因此,作者检测了H2S能否调节内皮细胞AMPK-YAP-PAI-1信号轴。结果表明,NaHS(H2S 供体)处理内皮细胞能激活AMPK 并诱导YAP的磷酸化(失活),同时抑制SERPINE1的表达,但敲低RKAA1后联合处理可以逆转对SERPINE1的抑制作用。之前的研究指出,在哺乳动物细胞中,H2S 由三种关键酶合成,包括胱硫醚γ-裂解酶(CTH),胱硫醚β醚合成酶(CBS)和巯基丙酮酸硫转移酶(MPST),其中MPST在内皮细胞中的表达最高。作者进一步分析了内皮细胞中MPST/H2S缺陷对AMPK-YAP-PAI-1信号的影响。结果表明,敲低内皮细胞中的MPST后抑制了AMPK 的表达,导致了YAP和SERPINE1的活化。接下来,作者探讨了 H2S与PAI-1表达和肺纤维化相关性。scRNA-seq数据表明,纤维化肺内皮细胞中MPST表达量的减少,与SERPINE1呈负相关。综上所述,纤维化肺内皮细胞中AMPK-YAP-PAI-1轴的功能障碍可能与MPST 的下调和内源性H2S的缺乏有关。
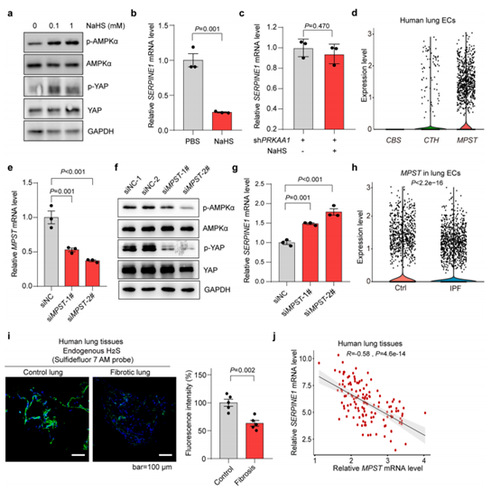
Result 6:H2S 以内皮细胞AMPK依赖性的方式减轻肺纤维化
最后作者分析了H2S合成酶MPST 的表达与纤维化之间的相关性。Spearman 相关分析显示,MPST 表达与纤维化肺中COL1A1,COL3A1,CCN2,FN1等基因的表达呈负相关,表明H2S缺乏可能导致肺纤维化。此外,Prkaa1WT和Prkaa1△EC的小鼠用博来霉素诱导肺纤维化后,腹膜内注射 H2S 供体 NaHS进行治疗。结果表明,补充H2S 后博来霉素诱导的Prkaa1WT肺纤维化减轻,但不能抑制Prkaa1△EC的肺纤维化。说明H2S 以内皮细胞AMPK依赖的方式抑制肺纤维化。

综上所述,该研究表明内皮细胞中H2S-AMPK轴是纤维化风险的传感器,传感器功能障碍会激活YAP和上调抗纤溶因子PAI-1的表达,从而导致肺纤维化进程。该论文阐明了纤维化条件下内皮细胞触发促纤维化血管分泌因子的机制,可能是治疗肺纤维化的潜在靶点。
原文链接:
https://www.sciencedirect.com/science/article/pii/S2213231724000144?via%3Dihub