

特发性肺纤维化(IPF)是一种慢性间质性肺疾病,可导致进行性肺疤痕形成和患者死亡。每一种免疫细胞类型都被认为在这种疾病中起作用,包括单核细胞、巨噬细胞、T细胞和B细胞,但免疫抑制治疗增加了IPF患者的死亡率。因此免疫系统在IPF中的作用尚未完全解决。随着单细胞技术的发展,将此技术应用于肺纤维化患者的组织中,获得了实质性的结果,并发现了肺中免疫细胞数量的变化,但仍缺乏外周血液中的变化。本文作者通过对肺纤维化中外周血单核细胞(PBMC)进行单细胞测序分析,提供了IPF外周血免疫系统的图谱。
2024年5月8日,耶鲁大学医学院团队在American Journal of Respiratory and Critical Care Medicine杂志发表了题为《Single-cell profiling reveals immune aberrations in progressive idiopathic pulmonary fibrosis》的研究论文,证明了IPF患者血浆和肺组织匀浆中可能涉及单核细胞的趋化物质和Tregs募集增加,提出了IPF存在肺-血免疫募集模式。

1、研究设计和单细胞聚类结果
作者根据在36个月的随访中患者是否死亡,分为了进展期IPF患者与稳定期的IPF患者。同时对12名进展期PF患者、13名稳定期IPF患者和13名对照的患者进行了PBMC的scRNA-seq(图1A)。最终的分析队列由30个集群的149564个细胞组成,聚集成23种细胞类型(图1B)。在三组患者中都检测到所有预期的细胞类型(图1C)。
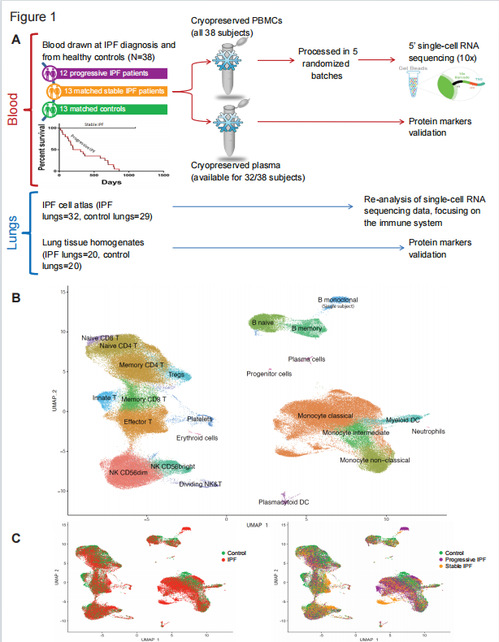
2、PBMC亚群与肺纤维化的发生以及纤维化加重程度相关
作者在对照、稳定和进展的样本中检测到细胞类型丰度的变化。具体变化为所有单核细胞(对照组为27.1%,稳定期为33.5%,进展期为43.3%;图2A)、典型单核细胞(17.9%、25.2%和32.1%;图2B)和中间单核细胞(1.9%、3.0%和4.7%)的平均计数逐渐增加。非经典单核细胞在三组间差异无统计学意义。与单核细胞的增加相反,淋巴细胞(T、B和NK)的水平呈现逐步下降的趋势(69.5%、62.6%和52.6%;图2A)。T淋巴细胞的显著变化包括进行性IPF中幼稚的CD4和CD8T细胞以及效应性T细胞的减少(图2B)。相反,进展期与稳定期相比,调节性T细胞(Treg)增加(1.8 %vs 1.1%,p=0.007)。

3、特发性肺纤维化患者与对照组PBMC基因表达谱的不同
与对照组相比,IPF(稳定期和进展期患者)的基因表达变化如图3所示。作者发现了IPF患者明显存在异常的髓系特征,S100A8和S100A12增加,而HLAII型转录本减少(图3A-B)。
与对照组相比,IPF组的单核细胞群中PPBP(血小板基因)的表达增加,受试者之间存在差异(图3C-D)。当血小板被激活时,可能会与单核细胞黏附,产生血小板-单核细胞复合体。在外周血单核细胞数据中发现了两簇血小板-单核细胞复合体,可能反映了IPF中血小板活化的增加,与单核细胞的粘附性增强。此外,在肺scRNA-seq的两个数据集中,肺纤维化组的单核细胞和巨噬细胞的PPBP水平也高于对照组。

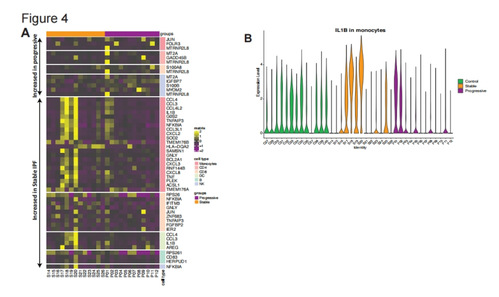
4、稳定期和进展期患者的PBMC基因表达变化
为了更好地展示稳定期患者与进展期患者PBMC亚群基因表达的不同(图4A),对这两组基因进行了富集途径分析。作者发现与进展期相比,稳定期IPF患者单核细胞中肿瘤坏死因子α和IL 1β通路(肿瘤坏死因子、白介素B、NFKBIA、CXCL2/3/8、CCL4、TNFAIP3、SOD2)均增加,表明至少在某些稳定期患者单核细胞中存在促炎状态(图4A-B)。缓解期IPF患者CD8+T细胞中肿瘤坏死因子α和白介素1β途径也明显增加,并伴有颗粒溶素的高表达。缓解期患者NK细胞中的几个MHC-II类分子升高,揭示了这些患者的NK细胞活性水平较高。相应地,缓解期IPF患者NK细胞中所有MHC-II类分子的综合评分(HLA2评分)均较高。总而言之,这些外周血液免疫系统的基因表达变化表明,与进展性疾病患者相比,稳定期IPF患者存在更活跃的促炎状态。
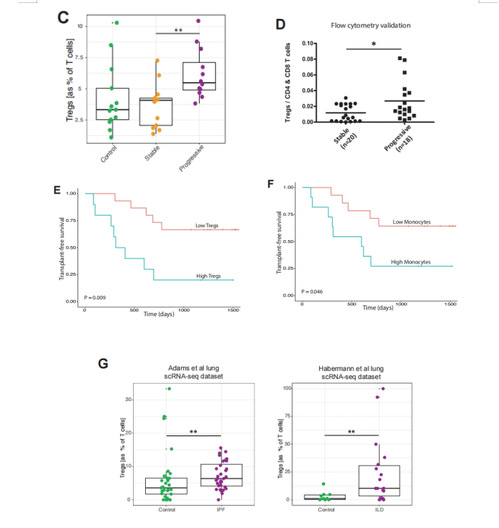
5、进展期纤维化患者的调节性T细胞在血液和肺中表现增加
作者发现进展性IPF患者与稳定期IPF患者,在外周血中Tregs的百分比(图2B)和在所有T细胞中Tregs的百分比图(4C)均升高。同时在流式细胞仪数据集中检测了以CD_4+和CD_8+T为主的Tregs细胞百分比(4D)。并在特发性肺纤维化患者队列中得到了验证,表明Treg水平可能具有预后意义:Treg计数较高的患者的死亡率明显较高(图4E)。这与单核细胞水平的生存曲线相似,单核细胞水平被认为是预后的指标(图4F)。根据这一观察,作者重新分析了肺组织中的scRNA-seq数据集,发现进展性纤维化肺与对照肺相比Tregs增加(图4G)。进展期患者外周血中TREG激活途径(转化生长因子β/SMAD、mTOR和IL-2途径)基因表达增加,干扰素γ途径降低。这些发现表明,在进展性IPF患者中,激活的Tregs可能从血液中招募到病变肺中,并与预后相关。
6、血浆中的趋化因子与肺中单核细胞和Treg的募集有关
为了寻找可能在IPF中单核细胞或Treg蓄积中起作用的特定细胞因子和趋化因子。作者测量了血浆中集落刺激因子和单核细胞趋化蛋白(CCL2、CCL7、CCL8、CCL13)的水平,这些是单核细胞上的主要趋化受体CCR2的配体(图5A)。对于Tregs,根据scRNA-seq数据显示CCR4和CCR8受体对Tregs具有高度特异性(图5A),分别测量了它们的配体(CCL17/CCL22和CCL1/CCL18)的血浆水平。
图5B显示了在IPF血浆中发现增加的三种主要趋化因子。在四种MCP中,CCL7(MCP-3)显示,无论是稳定性患者还是进展性患者,IPF血浆水平均显著高于对照组。对于CCR4配体,血浆CCL22水平有升高的趋势,无论是IPF组与对照组,尤其是进展性IPF组,而CCL17水平无明显变化。与对照组相比,IPF肺组织匀浆中CCL22水平显著升高。CCR8配体包括CCL1和CCL18,CCL1在IPF血浆中没有升高,发现了IPF患者的CCL18比对照组升高。

7、提出了特发性肺纤维化中肺-血募集模型,并预测单核细胞与淋巴细胞变化中的基因标志物
作者在前半部分展示了进行性IPF中单核细胞和Treg细胞的增加,以及特定的趋化因子可能在它们重新聚集到肺中发挥作用。接下来使用肺组织单细胞测序的数据集来确定上述趋化因子在IPF肺中的细胞来源。CCL22主要由肺内树突状细胞表达。巨噬细胞表达CCL18的水平最高。CCL7主要由巨噬细胞表达,而CCL13主要由巨噬细胞和肌成纤维细胞表达。基于这些发现,作者提出了IPF中的肺-血招募模型(图5C)。
同时作者进一步研究基因标志物的细胞起源,在外周血单核细胞的数据集中检测到52个基因中的50个(分别为7/7和43/45个基因)。与较短的无移植生存相关的7个增加的基因主要来自单核细胞,而43个减少的基因主要来自T、B和NK细胞(图6),这表明52个基因的特征至少部分是由进行性与稳定期IPF中观察到的单核细胞增加和淋巴细胞减少驱动的。

综上所述,本文从肺纤维化发生与纤维化加重的角度出发,研究了外周血中免疫细胞,发现了单核细胞与淋巴细胞的变化与生存预后有关,同时进一步探究了血浆中趋化蛋白的表达,根据肺组织单细胞测序的数据集确定了趋化蛋白的来源。因此作者提出了IPF中单核细胞和Treg细胞的肺血募集模型,为疾病进展提供了IPF患者外周血免疫系统的综合图谱。
原文链接:https://www.atsjournals.org/doi/10.1164/rccm.202306-0979OC?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed